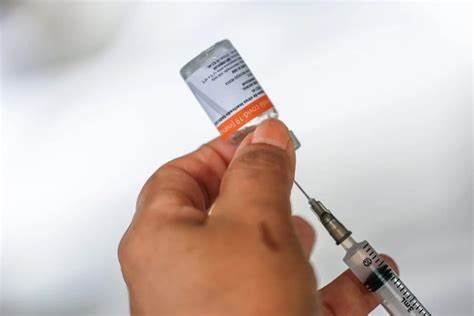
Reunião entre a agência, Instituto Butantan e representantes das sociedades médicas está marcada para amanhã (13/1)
Do portal Metrópoles – A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou, nesta terça-feira (11/1), que solicitou ao Instituto Butantan esclarecimentos adicionais sobre o estudo do uso da vacina Coronavac no público de 3 a 17 anos.
A pesquisa está sendo conduzida pelo Ministério da Saúde do Chile, que busca avaliar os dados de efetividade do uso da vacina Coronavac em crianças. Também foram solicitados pela agência ajustes no Plano de Gerenciamento de Riscos (PGR) da vacina.
Segundo a Anvisa, os dados enviados pelo Instituto Butantan haviam sido recebidos pela agência nesta segunda-feira (10/1).
Nesta quinta (13/1), uma reunião entre a agência, o instituto e representantes das sociedades médicas está marcada para “discussão dos dados e definição de eventuais compromissos, em caso de autorização de uso da vacina”.
Por enquanto, apenas o composto da Pfizer tem a autorização para ser utilizado em crianças no país.
Veja nota da Anvisa:
“Nesta segunda-feira (10/1), a Anvisa recebeu resposta às solicitações enviadas ao Instituto Butantan na sexta-feira (7/1), que dizem respeito à apresentação de dados relativos a um estudo conduzido pelo Ministério da Saúde chileno que buscou avaliar dados de efetividade do uso (dados de vida real) da vacina CoronaVac para crianças. Também foram solicitados pela Agência ajustes no Plano de Gerenciamento de Riscos (PGR) da vacina.
A Anvisa avaliou os dados enviados e solicitou, nesta terça-feira (11/1), esclarecimentos adicionais sobre o estudo de efetividade apresentado.
Também foi agendada para quinta-feira (13/1), às 10h, uma reunião entre a Agência, o Instituto Butantan e representantes das sociedades médicas para discussão dos dados e definição de eventuais compromissos, em caso de autorização de uso da vacina.
Por se tratar de uma solicitação de autorização de uso emergencial, a decisão é tomada pela Diretoria Colegiada, com base em subsídios apresentados pela Gerência-Geral de Medicamentos e Produtos Biológicos (GGMED) e pela Gerência de Farmacovigilância (GFARM). Cada diretor elaborará seu voto e, caso haja maioria simples para a aprovação, o uso emergencial será concedido”.
 Notícias
Notícias








 Entrevistas
Entrevistas Artigos
Artigos Colunas
Colunas Poços de Caldas
Poços de Caldas Agita Poços
Agita Poços Banco de Talentos
Banco de Talentos Classificados
Classificados